がん治療・再発予防がん遺伝子治療
壊れたがん抑制遺伝子の働きを回復し
からだ本来の働きでがんを抑え込む
がんと遺伝子
細胞は細胞分裂を繰り返し、古い細胞を新しい細胞に置き換えることで、常に細胞が正しい働きをするようにプログラムされています。この際、細胞の設計図ともいえる遺伝子も複製されます。
一方細胞は日々の生活習慣や化学物質、紫外線やホルモンなど細胞を傷つける様々な要因に日々さらされています。特に遺伝子が損傷した状態のまま複製された場合、誤った遺伝子の情報をもとに細胞が正しく機能しなくなることが考えられるため、遺伝子が壊れた場合はこれを修復し、これ以上複製しないようにするプログラムが遺伝子には備わっています。
このような遺伝子のことをがん抑制遺伝子と言いますが、このがん抑制遺伝子が傷ついてしまうと、壊れた遺伝子がそのまま複製されることで細胞が正しく機能しないばかりか、これを修復したりすることなく無限に壊れたままに増殖を繰り返す状態となります。
この状態に陥った細胞がいわゆる「がん細胞」です。がん遺伝子治療では、これを正しい情報を持った遺伝子に置き換えることで、細胞が本来持っている自己修復機能をもってがん細胞を抑制して、がん細胞を自死(アポトーシス)に追い込みます。
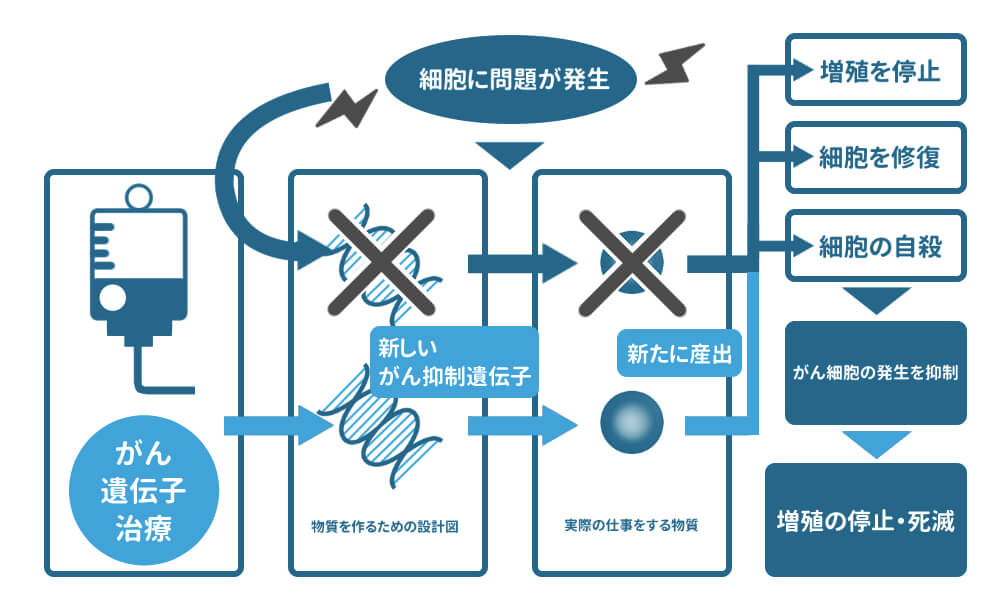
当院のがん遺伝子治療は、がん抑制機能を回復するため、がん抑制遺伝子を再び体内に点滴にて投与し、がん細胞の増殖を停止・死滅へと導きます。
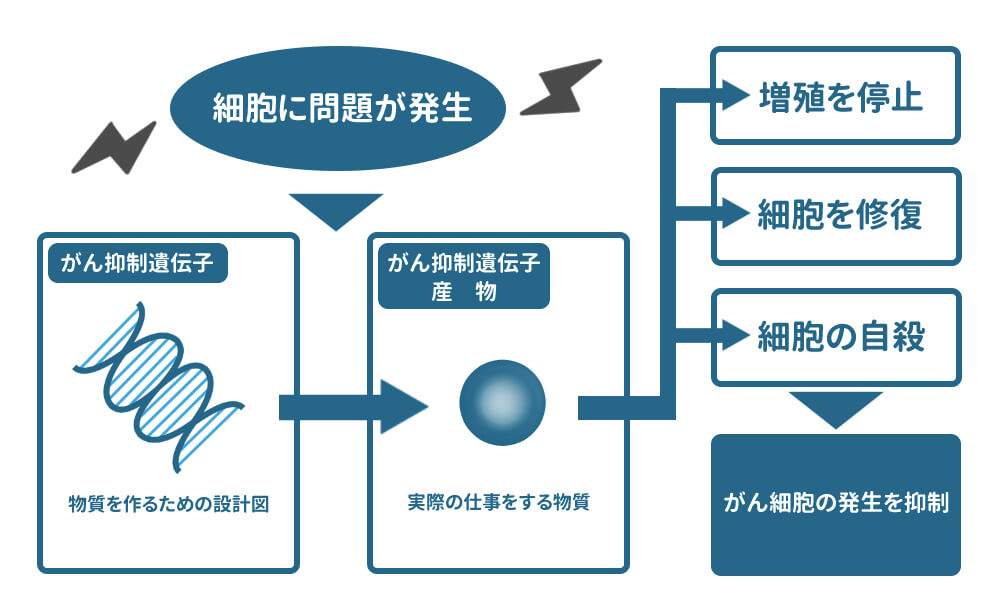
がん抑制遺伝子は、がん抑制遺伝子産物と言われるたんぱく質を作り出し、そのたんぱく質の働きで細胞のがん化にストップをかけます。抑制の方法は以下の3種類です。
(1)細胞増殖の停止
(2)細胞の機能修復する
(3)細胞の自死(アポトーシス)を誘導する

がん細胞はがん抑制遺伝子が壊れてしまっているので以下のことが起こります。
(1)自律性増殖(無限に増殖を続けること)
(2)浸潤と転移
(3)悪液質(他の正常組織の栄養を奪い衰弱させる。)
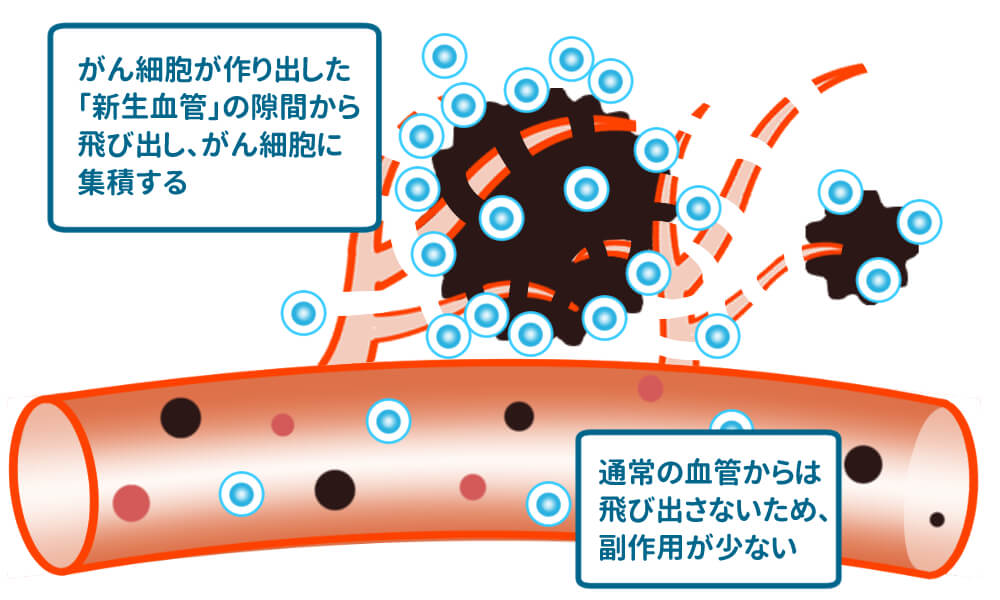
遺伝子をがん細胞に運ぶ仕組み
EPR効果
がん細胞は、新しい血管(新生血管)を作りだし、酸素や栄養を取り込もうとします。がん細胞が作った新生血管は血管壁が正常細胞の血管壁よりも粗く、100〜200nm程度の隙間が生じています。抗がん剤やがん治療に使う遺伝子の大きさは、通常で1nm以下の低分子です。このまま体内に投与すると、正常血管からも薬剤などが漏れ出してしまい、正常な組織にも届いて細胞を破壊してしまいます。抗がん剤などで副作用が出るのはこのためです。
そこで、薬剤等の大きさを100nm程度に加工し、正常血管からは漏れ出さず、新生血管からのみ漏れ出すように加工することで、がん細胞に集中的に蓄積されます。さらに、漏れ出した薬剤等は再び血管内に戻りにくい構造になっており、がん細胞周辺に滞留します。
この仕組みをEPR効果と言います。ノーベル賞候補にもなった熊本大学名誉教授の故・前田浩氏発見し、がん治療への応用が期待されている技術の一つです。
がん遺伝子治療の特徴
がん遺伝子治療は、がん抑制遺伝子を投与し、本来の体内に備わるがん抑制機構を再び機能させる治療です。もともと体にある遺伝子を投与しその機能の回復を図るだけなので、苦痛や副作用などの負担が少なく身体に優しい治療と言えます。また、遠隔転移がある末期がん(ステージⅣ)などでも適応が可能です。
末期がんの患者様等において遺伝子治療が特に有効な治療と考えられるのは、遺伝子治療を事前に行うことで抗がん剤治療や放射線治療の治療効果を増幅する効果が期待できる点です。 抗がん剤にしても放射線治療にしても、がん細胞に対して重篤な障害を人為的に与えることで、細胞に問題を発生させ、その危険信号に気づいたがん抑制遺伝子を強制的に働かせてがん細胞をアポトーシスに導こうとする治療です。
抗がん剤や放射線の効果が人により著しく異なるのは、細胞に問題を発生させてもそれに気づくべきがん抑制遺伝子がそのがん患者さんのがん細胞の中に正しく備わっていない場合があるからです。がん発生の原因は、がん抑制遺伝子の損傷にあることから抗がん剤治療や放射線治療を行っても、その仕組みが機能しにくいのもがん細胞の特徴と言えます。
がん遺伝子治療では、がん抑制遺伝子を正しい状態に置き換えてから抗がん剤や放射線治療を行うことで、この作用機序をしっかり機能させ、その本来の効果を発揮できるよう手助けします。
当院で末期がん(ステージⅣ)の患者様に抗がん剤治療や放射線治療を併用した場合の治療実績が以下の通りです。がんの種類別や治療内容ごとにこれを明らかにするには至ってはおりませんが、抗がん剤や放射線の治療前もしくは治療間にがん遺伝子治療を行ったケースにおいて、著しい効果を得られた症例が多くなっています。
また、これまで標準治療のみで効果が十分に得ることができなかった末期がんの患者様でも、がん遺伝子治療との組み合わせにより、これまで得られなかった治療効果が得られる症例もあります。また、これまで標準治療の適用にならなかった症例においても、遺伝子治療を併用することで、抗がん剤の投与量や放射線の照射量を軽減し、これらの治療の適応の幅を広げていく可能性も期待されます。
がん遺伝子治療は他の治療のスケジュールに合わせながら、また通常の生活を送りながらの通院治療も可能です。
がん遺伝子治療に用いる遺伝子
遺伝子の司令塔
p53
p53 は主要ながん抑制遺伝子であり、ヒト腫瘍の半数以上でその変異が認めらます。p53 遺伝子は、細胞のダメージやがん遺伝子の活性化などのストレスに対応し、多様な標的遺伝子を転写誘導し、細胞周期の停止やアポトーシスの誘導などによって細胞のがん化を防いでいます。
がん細胞を選択的に攻撃
TRAIL
TRAILは主要な腫瘍壊死因子の一つで、がん細胞に対して選択的にアポトーシスを誘導します。TRAILに対する受容体(デスレセプター)は主にがん細胞に発現しているため、正常細胞に対しては作用がほとんどないと期待され、がん細胞のみにその効果を発揮することが期待されます。
がん細胞に初期対応
p16
p16 INK4aはがん抑制遺伝子であり、多くのがん組織で変異やメチル化による不活性化がみられることから、p16が正しく機能しないことが細胞のがん化に深くかかわっていることが分かっています。細胞周期をコントロールしている抗体の 1つで、CDK4あるいはCDK6に結合し、そのキナーゼ活性を阻害することにより細胞周期を停止(細胞の増殖を抑制)し、細胞老化を誘導することでがんを抑制しています。
がん細胞増殖を抑制
CDC6
CDC6は、細胞を増殖させるために働くタンパク質で、細胞周期調整因子のひとつです。がん細胞にはこのCDC6が過剰に発現することから、これを阻害するCDC6shRNAを投与しがん細胞の増殖停止やアポトーシスに導きます。
CDC6shRNAは、RNA干渉(RNAi)技術を利用してCDC6のmRNAを分解しCDC6の発現を阻害します。
がん原遺伝子を制御
PTEN
アポトーシスの抑制や、細胞増殖に関与しているがん原遺伝子「AKT」の働きを制御する酵素です。PTENが異変や欠損している細胞ではAKTがアポトーシスを抑制するので、がんの増殖が加速してしまいます。正常なPTENを投与することで、AKTの働きを抑制します。
がん細胞分裂を制御
Rb
網膜芽細胞腫(Retinoblastoma)の原因遺伝子として初めて発見されたもので、細胞分裂が進むのを抑制する働きがあります。この異常があるがんでは、細胞がどんどん分裂し増殖していきます。網膜芽細胞腫以外でも、肺の小細胞がん、骨肉腫などで多く異常が報告されています。
様々ながん形成に関係
CDK4
この遺伝子の変異は、主要ながん抑制遺伝子であるp16やRb遺伝子などと関わり、様々な種類のがんにおいて腫瘍形成に関係しています。p16やRb遺伝子治療の前にこの働きを抑えることでがんの亢進を阻害します。また抗がん剤の「リボシクリブ」はCDK4とCDK6の阻害剤として、エストロゲン受容体陽性/HER2陰性の進行性乳がんに対する治療薬としてアメリカ食品医薬品局(FDA)に承認されています。また軟部肉腫など希少癌でも多く異常がみられることから幅広い癌に関係しているとみられます。
p53とRbとの併用で効果
PSMD10(ガンキリン)
がん抑制に重要な働きをするp53、Rb、PTEN遺伝子を十分に働かせるために使用します。過去の報告では単独での治療効果はあまり見れておりませんが、p53やRbと組み合わせることで効果が期待できます。
細胞分裂を促進しp53を阻害
MDM2
代表的ながん抑制遺伝子であるp53を阻害するものがMDM2タンパク質です。MDM2は細胞分裂促進機能があるため、正常細胞では組織の修復にも関与しています。しかし、p53が壊れた状態のがん細胞は、細胞の増殖を促進しているので、MDM2タンパク質をコードする遺伝子にブレーキをかけることで正常なp53を働きやすくします。
細胞増殖のアクセル役
KRAS
EGFR(上皮成長因子受容体)からの細胞増殖のシグナルを核に伝達し細胞増殖を進めるアクセルとしての機能を持っています。分子標的薬といわれる「アービタックス」や「ベクティビックス」はEGFRをターゲットにした治療薬ではありますが、このKRAS遺伝子に変異がある大腸がんの患者さまには効果がないという事が報告されており、実際に治療前にはKRAS遺伝子の変異があるかどうかを検査で判定し、分子標的薬の使用を検討します。日本人の大腸がんの40%程度はKRAS変異があるため、半分弱の大腸がんの患者さまは、これら分子標的薬が効果がないことと判断されます。遺伝子治療ではKRASのがん細胞を増殖させる働きを抑制させることを狙います。特に膵臓がんや肺腺がん、大腸がんに異常が多いのが特徴です。
がん遺伝子治療の適応について
一部の特殊ながん・小児がんを除いて治療対象になります。また一回の治療は点滴で40分程度ですので、食事がとれない方や歩行するのも体力的に厳しい方でも治療可能です。詳しくはお問い合わせください。
膵臓がん 食道がん 胃がん 肝がん 腎がん 胆道がん 膀胱がん 前立腺がん 甲状腺がん メラノーマ 肺がん 乳がん 子宮体がん 子宮頸がん 卵巣がん 口腔がん 咽頭がん など
※詳しくは医師にお問い合わせください。
こんな方が受けられています
- 副作用が少ないがん治療をご希望の患者さま
- 抗がん剤や放射線治療との併用を考えられている患者さま
- 抗がん剤などが使用できないなど、保険治療での加療方法がない患者さま
リスク・副作用
体細胞に特定の遺伝子断片を導入することによってがん細胞の発生抑制を図る治療です。遺伝子投与による次世代への影響はございません。
- 点滴の際に、まれに皮下血腫・神経損傷などの合併症が起きることがあります。
- 初回の点滴後に微熱がみられることがあります。(1%程度)
- すべての方に効果が現れるものではありません。
当院ではこれまでに重篤な副作用は見受けられていません。しかし、世界中で遺伝子治療が行われており、様々な副作用が報告されています。使用している遺伝子材料がクリニックによって違いますので、当院では国内の信頼できる研究所との提携で安心できる材料を使用しております。下記に他施設で報告されているものを列記します。
蕁麻疹、吐き気、軽度の白血球減少、腎機能障害、血液凝固障害など
報告だけみると、不安になられるかと思いますが、実際にどこの国のどの研究機関と材料提携するかが安全面において非常に重要だと思います。
当院で採用しています(2021年現在)遺伝子材料での副作用は、微熱が初回点滴をした日の夜間に見られる程度で、どの方も2回目以降には発熱はありません。
ただし、以下の患者さまについては、治療対象から除外されます
1) 重篤なアレルギーを有する、あるいは既往のある患者さま
2) 子ども、妊娠中の女性、妊娠が疑われる女性、あるいは授乳中の患者さま
3) その他、本治療により不利益を受けると予測される患者さま、および本人ならびに家族(あるいは親族)の文書による同意が得られない患者さまなど
治療の流れ
STEP-1 初診医師が、治療の内容について詳しくご説明致します。
STEP-2 治療計画立案患者さまごとに計画します。
STEP-3 遺伝子投与1回40分程度の外来点滴 6回を1クールで行います。
遺伝子期間中、サプリメントなどの内服を併用することもあります。
STEP-4 効果判定画像や血液データー(腫瘍マーカー)、CTC検査の結果を参考にその後継続可能な治療のプログラミングを行います。
承認医薬品等であることの明示、入手経路等の明示
本治療に用いる遺伝子は、医療機器等法上の承認を得ていないものです。院内調剤(一部外部 委託)として、適法に調剤しています。 日本では、未承認医薬品を医師の責任において使用することができます。
国内の承認医薬品等の有無の明示
本治療に使用できる同一の性能を有する他の国内承認医薬品はありません。
諸外国における安全性等に係る情報の明示
Germline-integrationのリスク評価
General Principles to Address the Risk of Inadvertent Germline Integration of Gene Therapy Vectors Oct. 2006
![京都御池メディカルクリニック[予防医療、検査、がん治療]](/common/images/logo_head.svg)